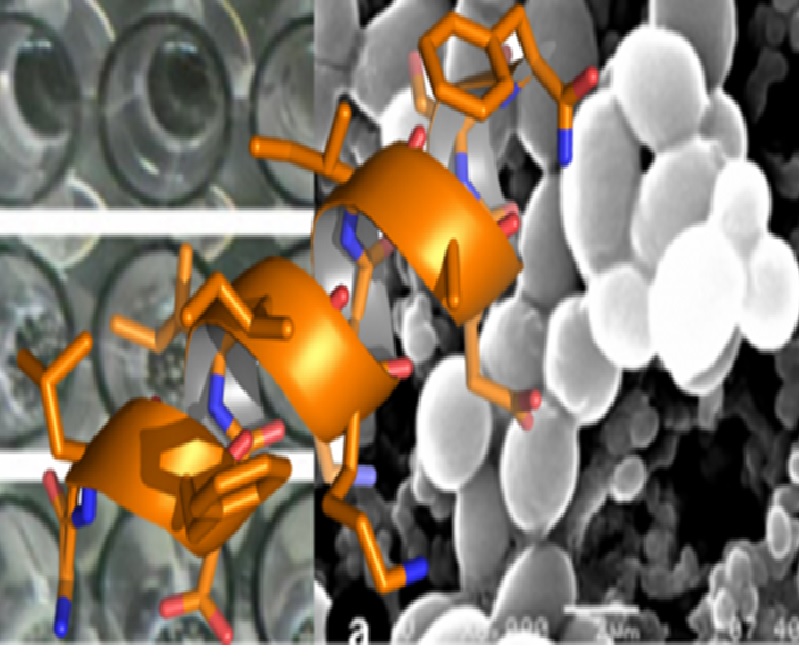
A resistência microbiana aos antibióticos tradicionais é um dos desafios mais preocupantes da farmacoterapia. Peptídeos com atividade antimicrobiana (AMPs) fazem parte dos mecanismos de defesa de animais, microorganismos e plantas, sendo conhecidos por apresentar um amplo espectro de atividade e raramente causar resistência. Além disso, estudos acerca de análogos diméricos dos AMPs têm demonstrado que eles possuem diversas vantagens farmacotécnicas, o que os torna candidatos promissores no desenvolvimento de novos agentes antimicrobianos.
Em artigo publicado na Amino Acids, pesquisadores do Instituto de Química e da Faculdade de Ciências Farmacêuticas da UNESP de Araraquara, avaliaram os efeitos da dimerização na estrutura e na atividade biológica de três AMPs: aureína 1.2 (AU), (AU)2K e E(AU)2.
Em experimentos de dicroísmo circular constatou-se que em água, a E(AU)2 apresenta estrutura do tipo coiled coil e (AU)2K estrutura-se em hélice-α. Em contraste, a (AU) apresenta um espectro típico de estruturas desordenadas. Em micelas, no entanto, todos os peptídeos adquirem um alto conteúdo de hélices-α.
Os autores também constataram que a atividade antimicrobiana contra bactérias e fungos decresce com a dimerização dos peptídeos. Porém, estes dímeros são capazes de promover a agregação de C. albicans. Os pesquisadores acreditam que a habilidade de agregar leveduras qualifica estas moléculas para o desenvolvimento de agentes especificamente planejados para inibir a adesão destes fungos aos alvos biológicos. Estes compostos também podem ser úteis para impedir a fixação destes microorganismos em dispositivos médicos.
Artigo científico: Lorenzón, E. N.; Sanches, P. R. S.; Nogueira, L. G.; Bauab, T. M.; Cilli, E. M. Dimerization of aurein 1.2: effects in structure, antimicrobial activity and aggregation of Candida albicans cells. Amino acids, v. 44, n. 6, p. 1521-1528, 2013.