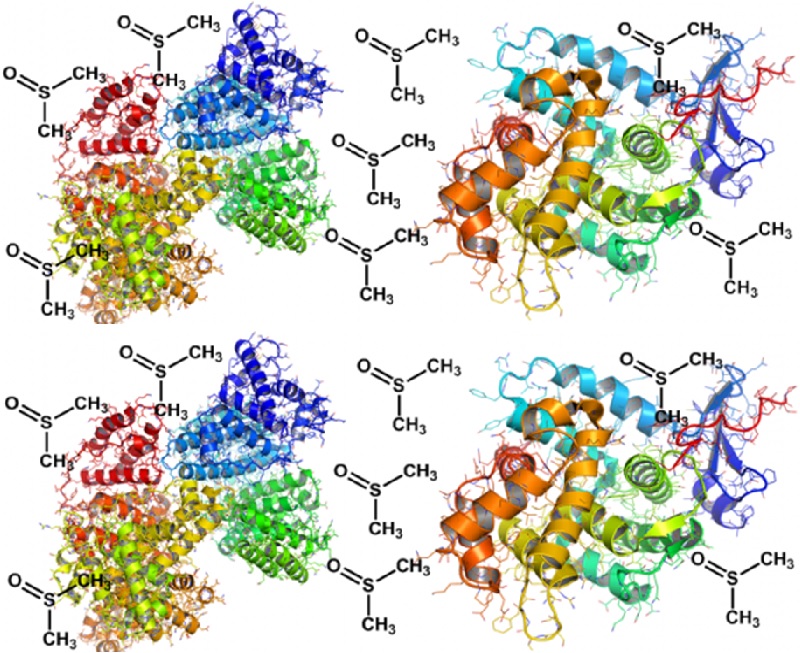
A função das proteínas é determinada pela sua estrutura, que por sua vez está relacionada ao solvente. Esta questão tem gerado grande interesse acerca dos mecanismos pelos quais os solventes não aquosos afetam a estrutura de biomoléculas. Em trabalho publicado na Physical Chemistry Chemical Physics, pesquisadores do Manchester Institute of Biotechnology e da Faculty of Life Sciences da University of Manchester e do Departamento de Química Orgânica da UNESP, utilizaram a espectroscopia Raman para investigar as alterações induzidas por DMSO, sobre a estrutura de uma série de proteínas, incluindo a albumina sérica, a lactoglobulina, a ribonuclease A e a caseína bovinas.
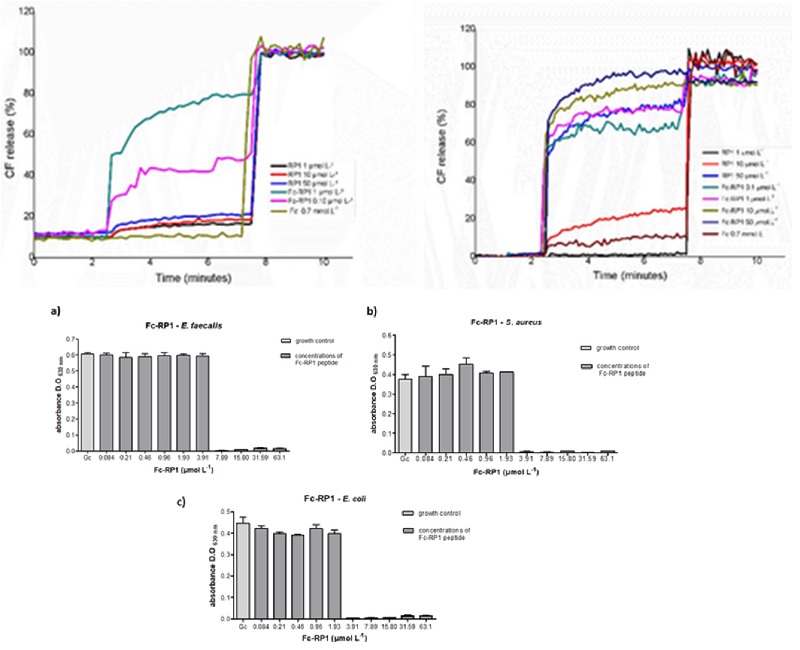
Os resultados demonstraram que soluções em DMSO a 100% são capazes de desestabilizar completamente as hélices-alfa de proteínas, convertendo-as em conformações compatíveis à poli-prolinas II (PPII). No entanto, concentrações mais baixas do solvente (10%) não produzem alterações estruturais, mesmo nas proteínas com maior conteúdo de hélices-alfa, como a albumina. Em relação à caseína, a estrutura nativa rica em hélices PPII, foi convertida em uma estrutura mais desordenada, quando dissolvida em DMSO puro. De maneira oposta, as folhas-beta se mantiveram intactas, independentemente da concentração do solvente.
Segundo os autores do trabalho, os efeitos seletivos do DMSO sobre as hélices-alfa estão relacionados com a competição entre as moléculas do solvente e os grupos carbonila das cadeias principais, pelo papel de aceptores de interações de hidrogênio. Esta hipótese torna-se mais factível ao se considerar a conversão das hélices-alfa, quando expostas ao DMSO, em estruturas PPII que por sua vez são caracterizadas pela ausência de interações de hidrogênio intramoleculares.
Além de revelar dados importantes sobre o comportamento da estrutura de proteínas em solventes orgânicos, o trabalho valoriza o uso da espectroscopia Raman nos estudos de alterações conformacionais de biomoléculas, principalmente em condições não alcançadas por outros métodos como a cristalografia de raios-x e a ressonância magnética nuclear.
Artigo científico: Batista, A. N.; Batista Jr, J. M.; Bolzani, V. S.; Furlan, M.; Blanch, E. W. Selective DMSO-induced conformational changes in proteins from Raman optical activity. Phys Chem Chem Phys, v. 15, n. 46, p. 20147-20152, 2013.